Легочное кровотечение после операции на сердце
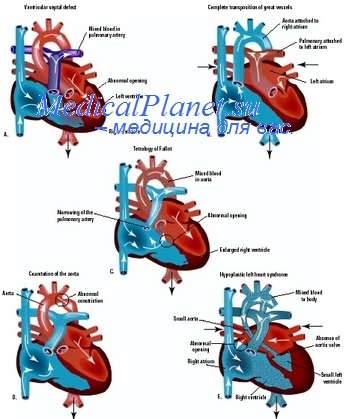
По механизму развития мы различаем три основных вида кровотечений, могущих быть причиной смерти во время и после операций по поводу врожденных пороков сердца:
1) кровотечения, возникающие вследствие технических погрешностей операции, главным образом в результате случайного ранения магистральных сосудов, легких и сердца; при этом мы различаем кровотечения, развившиеся в ранние и в поздние сроки после оперативных вмешательств;
2) кровотечения, развивающиеся в послеоперационном периоде в связи с назначением антикоагулянтов у больных, которым во время операции разделили богатые сосудами плевральные сращения; этот механизм кровотечения, как правило, наблюдается только у больных врожденными пороками сердца с уменьшенным кровотоком через легкие и цианозом;
3) кровотечения, причиной которых является «искусственная гемофилия», развивающаяся вследствие наводнения организма больного гепаринизированной кровью во время применения экстракорпорального кровообращения; кровотечения этого типа возникают вне зависимости от вида врожденного порока сердца и могут быть в любой части тела.
От кровотечений умерли 30 (22,22%) из 135 больных с врожденными пороками сердца.
Кровотечение из легочной артерии, случайно раненной во время операции, явилось причиной смерти 3 больных, один из которых страдал тетрадой Фалло, другой — пентадой Фалло, третий — незаращением боталлова протока; 2 больных погибли во время оперативного вмешательства, 1 больной — через 3 часа после него.
Кровотечение из кавапульмонального анастомоза явилось причиной смерти 2 больных тетрадой Фалло. Одна больная погибла через 1 час 25 минут, второй больной — через 3 часа после оперативного вмешательства.
Кровотечение из межсосудистого анастомоза, наложенного по методу Блелока — Тауссиг, явилось причиной смерти 2 больных тетрадой Фалло: один больной погиб через 3 часа после операции; второй больной погиб через 108 дней после оперативного вмешательства от кровотечения из разорвавшейся ложной аневризмы, развившейся в области левой подключичной артерии, вблизи анастомоза. В послеоперационном периоде больной получал гепарин.
Смерть больной К, 1 года 8 месяцев, страдавшей трикуспидальной атрезией, последовала через 12 часов после операции Блелока — Тауссиг от кровотечения из периферического конца пересеченной левой подключичной артерии, с которой соскользнула лигатура, наложенная во время операции.
Кровотечение из аорты было причиной смерти 2 больных тетрадой Фалло, один из которых умер во время оперативного вмешательства, а второй — через 15 минут после него.
Больному З., 22 лет, страдавшему врожденным «клапанным» сужением артериального конуса левого желудочка, была произведена операция вальвулотомии через стенку аорты. Рану аорты ушили капроновыми нитями с применением атравматических игл. Травма стенки аоргы на операции была минимальной.
Больной Т., 9 лет, страдавший тетрадой Фалло, погиб через 28 дней после операции Блелока—Тауссиг от кровотечений из раненного во время операции легкого. В развитии кровотечения из легкого играли роль нагноения раны, образование пневмоторакса и левосторонняя эмпиема плевры.
Больному Ф., 21 года, страдавшему общим артериальным стволом и дефектом межжелудочковой перегородки, в клинике был поставлен ошибочный диагноз: тетрада Фалло. Во время попытки наложения межсосудистого анастомоза был ранен сосуд, питающий правое легкое. Массивное кровотечение из раненого сосуда явилось причиной смерти больного.
Больному А., 12 лет. В результате применения гепаринизированной крови в аппарате в послеоперационном периоде развилось нарушение свертывающей системы крови: больной потерял свыше 4 л крови. Смерть больного последовала в результате массивного кровоизлияния в плевральные полости и в полость желудочно-кишечного тракта.
Смерть больной П., 11 лет, страдавшей триадой Фалло, наступила через 10 дней после вальвулотомии от массивного кровотечения в полость желудочно-кишечного тракта. Кровотечение возникло в связи с применением антикоагулянтов (гепарина и дикумарина) в послеоперационном периоде.
Больной X., 20 лет, страдавший аорто-пульмональным свищом, умер в результате массивного кровотечения в левую плевральную полость. Медленное, но непрерывное кровотечение из раны грудной стенки следует объяснить резкими застойными явлениями в венозной системе, усугубляющимися декомпенсацией гипертрофированного сердца
Смерть больной И., 15 лет, страдавшей дефектом межпредсердной и межжелудочковой перегородок, последовала в конце операции от кровотечения, обусловленного просачиванием крови через шов, наложенный на правое предсердие.
Смерть больной К., 7 лет, страдавшей тетрадой Фалло, наступила в результате кровотечения из поврежденной во время операции левой подключичной артерии. В веществе головного мозга обнаружены, диапедезные кровоизлияния (в том числе в продолговатом мозгу). По-видимому, это обусловлено крайней степенью сужения артериального конуса правого желудочка в связи с развившимся в месте сужения бородавчатым эндокардитом. Сами по себе множественные очаги кровоизлияний в продолговатом мозгу (14 очагов) могли явиться причиной смерти больной. Доказательстьом наличия тяжелых гемодинамических нарушений в головном мозгу в прошлом, до операции, является старая киста после размягчения в левой лобной доле мозга.
Больная Б., 29 лет, страдавшая тетрадой Фалло с резким «клапанным» сужением артериального конуса правого желудочка, погибла через 2 дня после операции левосторонней торакотомии и деплевризации от кровоизлияния в столовую часть мозга. Последнее развилось на фоне тяжелых, хронических расстройств гемодинамики и ликвородинамики в головном мозгу. Обращает на себя внимание «конкуренция» причин смерти. Само по себе массивное кровотечение в левую плевральную полость (1200 мл крови), развившееся у больной, могло быть смертельным. Неудачная паллиативная операция, осложнившаяся кровотечением и ателектазом левого легкого, миогенная дилятация резко гипертрофированного сердца, пораженного кардиосклерозом, — все это могло усилить уже имевшиеся изменения в головном мозгу.
Больной Г., 7 лет, страдал тетрадой Фалло с резко выраженным инфундибулярным сужением артериального конуса празэго желудочка. В связи с развитием эмболии левой подколенной артерии была произведена двусторонняя поясничная новокаиновая блокада и введено 10 000 единиц гепарина. Смерть больного последовала в результате кровотечения в забрюшинную клетчатку, развившегося вследствие ранения иглой правой почки.
— Читать далее «Кровотечение из плевральных спаек после операции на сердце. Тромбоз легочной артерии после коррекции порока сердца»
Оглавление темы «Смертность при ВПС»:
1. Смерть больных с врожденными пороками сердца. Причины смерти при пороке сердца
2. Мозговые осложнения при пороке сердца. Мозговые причины смерти при ВПС
3. Декомпенсация кровообращения при пороке сердца. Декомпенсация сердца как причина смерти
4. Острая сердечная недостаточность при пороке сердца. Смерть после операции на сердце
5. Обтурационный ателектаз легких при пороке сердца. Легочно-сердечная недостаточность при ВПС
6. Смерть при незаращении боталлова протока. Смерть пациента при коррекции порока сердца
7. Виды кровотечений при операции на сердце. Кровотечение из анастомозов после коррекции порока сердца
8. Кровотечение из плевральных спаек после операции на сердце. Тромбоз легочной артерии после коррекции порока сердца
9. Смертность детей при атрезии легочной артерии. Причины смерти после коррекции ВПС
10. Причины врожденных пороков сердца. Компенсация врожденных пороков сердца
Источник
Коагулопатия — обычное следствие использования АИК, связанное с уменьшением факторов свертываемости крови, фибринолизом, неадекватной нейтрализацией гепарина, чрезмерным применением протамина сульфата и других препаратов и нарушением процесса тромбообразования. Было высказано предположение, что агрегация тромбоцитов, индуцированная применением АИК, не может быть вызвана факторами, связанными с системой трубок или покрытием оксигенатора, но может провоцироваться короткими эпизодами высокого напряжения сдвига, длительность которых во многом зависит от аденозиндифосфага (АДФ).
Пациенты после КШ без АИК защищены от активации коагуляции и фибринолиза и повреждения эндотелия только в интраоперационном периоде, затем следует протромботический период, сопоставимый с таковым у пациентов, которым выполняли КШ с АИК (по крайней мере, в течение 30 дней после операции). Было показано, что гемодилюция с низким уровнем гематокрита (< 19%) не вносила существенного вклада в послеоперационное кровотечение. В отличие от стандартной оценки коагуляции (протромбиновое время, уровни фибриногена, D-димера, тромбоцитов) функция тромбоцитов, оцененная с помощью тромбоэластографа, и агрегометрия цельной крови могут предсказать и кровотечения, и тромбозы после КШ без АИК.
Для уменьшения кровопотери и объемов гемотрансфузии в периоперационном периоде были рассмотрены определенные фармакологические подходы и прием антитромботических препаратов. Аналоги лизина, такие как ε-аминокапроновая кислота (амикар) или транексамовая кислота, стоят недорого и эффективно снижают кровопотерю по грудным дренажам и трансфузионные потребности после АИК.
Ингибиторы сериновых протеаз, например апротинин в высоких дозах, снижают воспалительные реакции, связанные с КШ, но стоят дорого. Метаанализ не выявил значимых различий в эффективности между этими двумя классами препаратов. Было изучено специфическое использование апротинина после операций на сердце. Благодаря своим антифибринолитическим свойствам и за счет ингибирования контактной активации апротинин способствует и гемостатическому, и антитромботическому эффектам, снижая дисфункцию тромбоцитов и подавляя воспалительный ответ на АИК. Эти эффекты не влияют на показатели смертности, частоту ИМ или риск развития почечной недостаточности, но снижают риск инсульта и ФП.
В ретроспективном исследовании 1524 кардиохирургических пациентов с высоким риском развития послеоперационных инсультов применение полной дозы апротинина было связано с более низкой частотой инсультов. Предполагают, что для защиты органов-мишеней нужно более сильное ингибирование калликреина, что и обеспечивает полная доза. Препарат снижает риск периоперационного кровотечения во время КШ без АИК. Десмопрессина ацетат повышает уровни фактора VIII и фактора Willebrand в сыворотке в 2-20 раз и высвобождает ТАП и простациклин из эндотелия сосудов. Препарат может быть полезен при легкой и умеренной формах гемофилии или болезни Willebrand, у пациентов с уремией и нарушением функции тромбоцитов, а также при определенных формах послеоперационных нарушений функции тромбоцитов, выявленных с помощью специальных тестов.
Использование рекомбинантного активированного фактора VII для экстренной терапии при тяжелых, неконтролируемых, нехирургических кровотечениях и кровотечениях после кардиохирургических вмешательств является эффективным и безопасным методом, не связанным с неблагоприятными неврологическими и сердечно-сосудистыми эффектами.
Факторами риска (ФР) для реторакотомии по поводу кровотечения после КШ служат пожилой возраст, сниженный ИМТ, неплановые операции, 5 и более дистальных анастомозов. Для пациентов из группы КШ с АИК ФР являются дооперационный прием аспирина и гепарина. Пациенты, нуждающиеся в реторакотомии, имеют высокий риск развития осложнений при увеличенной длительности операции. Реторакотомия в ОИТ по поводу кровотечения или тампонады после операции на сердце может быть безопасной альтернативой возвращению в операционную.
Следует разумно подходить к периоперационной трансфузии заготовленных эритроцитов, т.к. возможны иммуномодуляция, передача болезней и воздействие гуморальных и клеточных антигенов. Уменьшение гемотрансфузий связано со снижением скорректированной по риску выживаемости в течение года после КШ, при этом большая часть летальных исходов наблюдается в течение 30 дней. В группе кардиохирургических больных риск пневмонии увеличивается на 5% за каждую перелитую дозу эритроцитов или тромбоцитов, с более высокой степенью риска за каждый день хранения крови. Однако последние наблюдения показывают, что применение крови как таковой не приводит к увеличению послеоперационных инфекций.
Для снижения частоты послеоперационных гемотрансфузий показан контроль коагуляции у постели больного с использованием тромбоэластографа. Дооперационное введение эритропоэтина в течение недели ассоциируется с более высокой концентрацией гемоглобина и умеренным снижением необходимости трансфузий. Кроме того, интраоперационный забор гепаринизированной аутологичной крови перед использованием АИК у гемодинамически стабильных пациентов и ретрансфузия ее после вмешательства, интраоперационное «сохранение» клеток крови и аутотрансфузия отмытых эритроцитов снижают потребность в гемотрансфузии. Объем крови, необходимый для оксигенатора и трубок, должен быть возвращен без обработки клеток и гемофильтрации.
При использовании кардиотомных резервуаров с твердыми стенками для сердечно-легочного аппарата аутотрансфузию стернальной крови после операции можно проводить каждый час (до 18 час). Используя эти методы, трансфузии гомологичных эритроцитов можно избежать в 98,6% случаев. Однако посткардиогомный забор и аутотрансфузия крови из средостения могут вносить свой вклад в периоперационный воспалительный ответ. Применение АИК с закрытым контуром связано со значительно меньшим повреждением эритроцитов и снижением активации каскадов коагуляции, подобно КШ без АИК, но при АИК с закрытым контуром маркеры фибринолиза и ИЛ-6 после операции заметно увеличиваются.
Существенно ниже необходимость в послеоперационной гемотрансфузии и реторакотомии, ассоциируемой с кровотечением, после КШ без АИК, что позволяет избежать заболеваемости и смертности, связанных с чрезмерной кровопотерей после операции. Отмечается тенденция к меньшей активации коагуляции и фибринолиза у пациентов с низким риском во время плановой КШ без АИК по сравнению с КШ с АИК.
Учебное видео расшифровки коагулограммы в норме и при отклонениях
— Читать «Нарушение функции почек после операции на сердце»
Редактор: Искандер Милевски. Дата публикации: 12.2.2019
Источник
Легочное кровотечение – опасное осложнение различных заболеваний органов дыхания, сопровождающееся истечением крови из бронхиальных или легочных сосудов и ее выделением через воздухоносные пути. Легочное кровотечение проявляется кашлем с выделением жидкой алой крови или сгустков, слабостью, головокружением, гипотонией, обморочным состоянием. С диагностической целью при легочном кровотечении проводится рентгенография легких, томография, бронхоскопия, бронхография, ангиопульмонография, селективная ангиография бронхиальных артерий. Остановка легочного кровотечения может включать проведение консервативной гемостатической терапии, эндоскопический гемостаз, эндоваскулярную эмболизацию бронхиальных артерий. В дальнейшем для устранения источника легочного кровотечения, показано хирургическое лечение с учетом этиологических и патогенетических факторов.
Общие сведения
Легочное кровотечение относится к числу наиболее опасных состояний, осложняющих течение широкого круга заболеваний бронхо-легочной и сердечно-сосудистой систем, болезней системы крови и гемостаза. Поэтому проблема оказания неотложной помощи при легочном кровотечении актуальна для специалистов в области пульмонологии, фтизиатрии, онкологии, кардиологии, гематологии, ревматологии. Промедление с проведением экстренных гемостатических мероприятий может вызвать быструю гибель больных. В зависимости от выраженности кровопотери и состояния, ее обусловившего, летальность от легочного кровотечения варьирует от 5-15% до 60-80%. Среди пациентов с легочным кровотечением преобладают лица зрелого возраста (50-55 лет) с отягощенной соматической патологией.
Легочное кровотечение
Причины легочного кровотечения
Частая встречаемость кровохарканья и легочного кровотечения определяется полиэтиологичностью данных состояний. Первое место в структуре причин легочного кровотечения принадлежит туберкулезу легких (свыше 60% наблюдений). Значительная роль в этиологии легочных кровотечений отводится неспецифическим и гнойно-деструктивным заболеваниям — бронхиту, хронической пневмонии, бронхоэктазам, пневмосклерозу, абсцессу и гангрене легкого.
Нередко причинами легочного кровотечения выступают аденома бронха, злокачественные опухоли легких и бронхов, паразитарные и грибковые поражения (аскаридоз, эхинококкоз, шистозоматоз, актиномикоз легких), пневмокониозы (силикатоз, силикоз). Легочные кровотечения могут быть обусловлены неадекватным местным гемостазом после эндоскопической или трансторакальной биопсии, хирургического вмешательства на легких и бронхах. К легочному кровотечению могут приводить инородные тела бронхов, травмы грудной клетки (перелом ребер и др.).
Кроме болезней органов дыхания, кровохарканье и легочное кровотечение могут возникать при заболеваниях сердца и сосудов: ТЭЛА, митральном стенозе, аневризме аорты, артериальной гипертензии, атеросклеротическом кардиосклерозе, инфаркте миокарда. К числу относительно редких причин легочного кровотечения относятся легочный эндометриоз, гранулематоз Вегенера, системный капиллярит (синдром Гудпасчера), наследственная телеангиэктазия кожи и слизистых оболочек (синдром Рендю-Ослера), геморрагические диатезы и др. Легочное кровотечение может быть обусловлено нарушением свертываемости крови при длительной и плохо контролируемой терапии антикоагулянтами.
Факторами, провоцирующими легочное кровотечение, могут выступать физическая или эмоциональная нагрузка, инфекции, инсоляция, расстройства гемодинамики, легочная гипертензия, менструация (у женщин) и др.
Патогенез
Морфологическую основу для легочного кровотечения составляют истонченные и аневризматически расширенные ветви легочной артерии или бронхиальные артерии, а также легочные вены. Разрыв или аррозия измененных сосудов могут сопровождаться легочным кровотечением различной степени тяжести. При этом величину легочного кровотечения в значительной степени определяет калибр поврежденного сосуда, а выраженность происходящих в организме нарушений — темп и интенсивность кровопотери.
Развивающиеся в дальнейшие расстройства связаны с обтурацией дыхательных путей излившейся кровью и собственно величиной кровопотери. Попадая в бронхи даже в небольших количествах, кровь вызывает развитие обтурационных ателектазов и аспирационной пневмонии. В свою очередь, это приводит к уменьшению объема функционирующей легочной ткани, расстройствам газообмена, прогрессирующему нарастанию дыхательной недостаточности, гипоксемии.
Гиповолемия и анемия, сопровождающие острую и хроническую (при рецидивирующих легочных кровотечениях) кровопотерю, приводят к общему нарушению гомеостаза. Это, прежде всего, выражается в активизации фибринолитических и антикоагулянтных механизмов, что вызывает усиление склонности к гипокоагуляции, повышение проницаемости сосудистых стенок. Совокупный результат подобных изменений определяет патологическую готовность организма к возобновлению легочного кровотечения в любой момент.
Классификация
В клиническом аспекте важно разграничить легочное кровотечение и другое, менее опасное, но более часто встречающееся состояние – кровохарканье. Кровохарканье отличается по объему и темпу выделения крови из воздухоносных путей. В ряде случаев кровохарканье предшествует массивному легочному кровотечению, поэтому также требует проведения полного клинико-рентгенологического обследования и неотложных мер по его купированию. Обычно под кровохарканьем понимают выделение при кашле мокроты с прожилками или примесью крови; при этом количество выделяемой крови не превышает 50 мл в сутки. Увеличение объема откашливаемой крови расценивается как легочное кровотечение.
В зависимости от объема выделяемой при кашле крови различают малое легочное кровотечение (50-100 мл в сутки), среднее (100-500 мл в сутки), обильное или тяжелое легочное кровотечение (свыше 500 мл крови в сутки). Особенно опасны «молниеносные» обильные кровотечения, возникающие одномоментно или в течение короткого отрезка времени. Как правило, они приводят к острой асфиксии и летальному исходу.
В отличие от гемоторакса, легочное кровотечение относится к наружным кровотечениям. Также встречается смешанное легочно-плевральное кровотечение.
Симптомы легочного кровотечения
Клиника легочного кровотечения складывается из симптомокомплекса, обусловленного общей кровопотерей, наружным кровотечением и легочно-сердечной недостаточностью. Началу легочного кровотечения предшествует появление сильного упорного кашля, вначале сухого, а затем – с отделением слизистой мокроты и алой крови или откашливанием сгустков крови. Иногда незадолго до легочного кровотечения в горле возникает ощущение бульканья или щекотания, чувство жжения в грудной клетке на стороне поражения. В начальный период легочного кровотечения отделяющаяся кровь имеет ярко-красный цвет, позднее становится более темной, ржаво-коричневой. При обтурации бронха сгустком крови, легочное кровотечение может прекратиться самостоятельно.
Общее состояние определяется выраженностью кровопотери. Для пациентов с легочным кровотечением характерны испуганный вид, адинамия, бледность кожного покрова лица, холодный липкий пот, акроцианоз, снижение АД, тахикардия, головокружение, шум в ушах и голове, одышка. При обильном легочном кровотечении может возникать нарушение зрения (амавроз), обморочное состояние, иногда рвота и судороги, асфиксия. На 2-3 сутки после легочного кровотечения может развиваться картина аспирационной пневмонии.
Диагностика
Для установления причины легочного кровотечения нередко требуется проведение диагностического консилиума с участием специалистов пульмонологов, фтизиатров, торакальных хирургов, онкологов, рентгенологов, сосудистых хирургов, кардиологов, отоларингологов, ревматологов, гематологов. При аускультативном обследовании определяются влажные среднепузырчатые хрипы в легких и булькающие хрипы в области грудины. При аспирации крови отмечается укорочение перкуторного звука, шум трения плевры, ослабление дыхания и голосового дрожания.
Источник кровотечения предположительно можно определить по цвету крови. Выделение алой, пенистой крови, как правило, указывает на легочное кровотечение; крови темно-красного, кофейного цвета – на желудочно-кишечное кровотечение. Иногда клинику кровохарканья может симулировать носовое кровотечение, поэтому с целью дифференциальной диагностики важно проведение консультации отоларинголога и риноскопии. В сомнительных случаях, с целью исключения кровотечения из ЖКТ, может потребоваться проведение ЭГДС.
Для подтверждения источника кровотечения в легких выполняется рентгенологическое обследование: полипозиционная рентгенография легких, линейная и компьютерная томография, МРТ легких. При необходимости прибегают к углубленному рентгенологическому обследованию: бронхографии, бронхиальной артериографии, ангиопульмонографии.
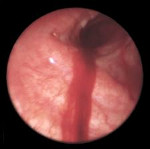
Ведущими методом инструментальной диагностики при легочном кровотечении является бронхоскопия. Эндоскопическое исследование позволяет визуализировать источник кровотечения в бронхиальном дереве, выполнить аспирацию промывных вод, щипцовую и скарификационную биопсию из зоны патологических изменений.
В периферической крови при легочном кровотечении выявляется гипохромная анемия, пойкилоцитоз, анизоцитоз, снижение гематокритного числа. С целью оценки выраженности изменений в свертывающей и противосвертывающей системах крови исследуется коагулограмма и количество тромбоцитов. В анализах мокроты (микроскопическом, ПЦР, на кислоустойчивые микобактерии) могут определяться атипичные клетки, микобактерии туберкулеза, указывающие на этиологию легочного кровотечения.
Лечение легочного кровотечения
В лечении легочного кровотечения используются консервативные методы, местный гемостаз, паллиативные и радикальные хирургические вмешательства. Терапевтические мероприятия применяются при легочных кровотечениях малого и среднего объема. Пациенту назначается покой, придается полусидячее положение, накладываются венозные жгуты на конечности. Для удаления крови из просвета трахеи проводится трахеальная аспирация. При асфиксии требуется экстренная интубация, отсасывание крови и ИВЛ.
Медикаментозная терапия включает введение гемостатических препаратов (аминокапроновой кислоты, кальция хлорида, викасола, этамзилата натрия и др.), гипотензивных средств (азаметония бромида, гексаметония бензосульфонат, триметафан камсилата). С целью борьбы с постгеморрагической анемией производится заместительная трансфузия эритроцитной массы; для устранения гиповолемии вводится нативная плазма, реополиглюкин, декстран или раствор желатина.
При неэффективности консервативных мер прибегают к инструментальной остановке легочного кровотечения с помощью местного эндоскопического гемостаза. Лечебная бронхоскопия должна выполняться в операционной, в условиях готовности перехода к экстренной торакотомии. Для эндоскопического гемостаза могут использоваться местные аппликации с адреналином, этамзилатом, р-ром перекиси водорода; установка гемостатической губки, электрокоагуляция сосуда в месте истечения крови, кратковременная окклюзия надувным баллончиком типа Фогарти или временная обтурация бронха поролоновой пломбой. В ряде случаев эффективной оказывается эндоваскулярная эмболизация бронхиальных артерий, проводимая под контролем рентгена.
В большинстве случаев, перечисленные методы позволяют временно остановить легочное кровотечение и избежать неотложного оперативного вмешательства. Окончательный и надежный гемостаз возможен только при хирургическом устранении источника кровотечения.
Паллиативные вмешательства при легочном кровотечении могут включать оперативную коллапсотерапию при туберкулезе легких (торакопластику, экстраплевральную пломбировку), перевязку легочной артерии или сочетание этого хирургического приема с пневмотомией. К паллиативным вмешательствам прибегают лишь в вынужденных ситуациях, когда радикальная операция по каким-либо причинам невыполнима.
Радикальные операции по поводу легочного кровотечения предполагают удаление всех патологически измененных участков легкого. Они могут заключаться в частичной резекции легкого в пределах здоровых тканей (краевой резекции, сегментэктомии, лобэктомии, билобэктомии) или удалении всего легкого (пневмонэктомии).
Прогноз
Даже однократное и самостоятельно остановившееся легочное кровотечение всегда потенциально опасно в плане возобновления. Обильное легочное кровотечение угрожает жизни больного. В тяжелых случаях смерть наступает в результате асфиксии, вызванной закупоркой воздухоносных путей сгустками крови и одновременным спастическим сокращением бронхов. Процент послеоперационных осложнений и летальности при операциях, выполняемых на высоте легочного кровотечения, более чем в 10 раз превышает аналогичные показатели при плановых операциях.
Источник


