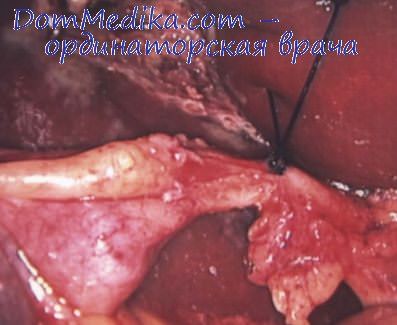
Кровотечение из пузырной артерии
В процессе выделения шейки ЖП может произойти повреждение пузырной артерии или соскальзывание лигатуры с ее культи. При поспешной остановке артериального кровотечения могут возникнуть тяжелые осложнения: повреждение ВЖП, правой печеночной артерии, воротной вены. Избежать перечисленных осложнений позволяет несколько технически простых приемов, обеспечивающих гемостаз.
Временную остановку кровотечения обеспечивают прижатием кровоточащей артерии тупфером. Если после этого кровотечение продолжается, то временного гемостаза добиваются пережатием ПДС пальцами. Иногда бывает достаточно ввести в сальниковое отверстие указательный палец левой руки и приподнять им ПДС, что обеспечивает сдавление сосудов. Для выполнения этого приема хирург должен повернуться к больному правым боком. Добившись временной остановки кровотечения, электроотсосом аспирируют излившуюся кровь, что позволяет осмотреть область вмешательства.
Как правило, при этом удается увидеть поврежденный сосуд. Если источник кровотечения не виден, то следует кратковременно ослабить натяжение или пережатие связки и после возобновления кровотечения локализовать источник. Культю желчно-пузырной артерии захватывают длинным мягким кровоостанавливающим зажимом с минимальным количеством окружающих тканей. Убеждаются в том, что в зажим не захвачены прилежащие трубчатые структуры ПДС. Если культя артерии относительно длинная и лигатура ложится надежно, то возможно перевязывание культи без прошивания.
При короткой культе тотчас у кончика браншей зажима накладывают Z-образный шов атравматической иглой с нерассасывающимся шовным материалом 3-0 или 4-0 таким образом, чтобы в шов попали только культя пузырной артерии и окружающая ее жировая клетчатка.
При резкой инфильтрации тканей во время мобилизации шейки ЖП кровотечение может возникнуть вследствие пристеночного отрыва желчно-пузырной артерии от основного сосуда — правой печеночной артерии. В таком случае накладывать кровоостанавливающий зажим нельзя. Кровотечение следует временно остановить, как было описано выше. Осушив рану, устанавливают локализацию краевого дефекта правой печеночной артерии и, не ослабляя натяжения гепатодуоденальной связки, накладывают пристеночный шов атравматической иглой с нитью 4-0 или 5-0.
Выделение ЖП из ложа при остром холецистите не всегда удается выполнить строго «в слое». В результате может происходить поверхностное повреждение прилежащей воспалительно измененной паренхимы печени, сопровождающееся кровотечением. Электрокоагуляция ложа в процессе выделения пузыря может оказаться неэффективной. Для остановки такого паренхиматозного кровотечения применяют ушивание ложа пузыря рассасывающимся шовным материалом на атравматической игле. Возможно наложение как непрерывного, так и узловых швов. Обязательным условием при прошивании ложа является достаточно грубое наложение швов на глубину до 1 см.
При поверхностном прошивании инфильтрированной ткани печени швы неизбежно прорезаются, интенсивность кровотечения увеличивается. В то же время излишне глубокое прошивание паренхимы печени в области ложа пузыря может привести к захватыванию в шов сегментарных ПП и сосудов.
Эффективным способом остановки интенсивного кровотечения из ложа ЖП является аппликация пластины ТахоКомб. При этом предварительное ушивание ложа не требуется.
— Читать далее «Желчеистечение при холецистэктомии. Диагностика и остановка желчеистечения»
Оглавление темы «Холецистэктомия. Хирургический стресс»:
1. Кровотечение при холецистэктомии. Остановка кровотечения из ложа желчного пузыря
2. Желчеистечение при холецистэктомии. Диагностика и остановка желчеистечения
3. Холецистэктомия по Прибраму. Модификации удаления желчного пузыря по Прибраму
4. Операции при травмах желчного пузыря. Лапароскопическая холецистэктомия
5. Техника ЛХЭ американской школы. Лапароскопическое устранение острого холецистита
6. Трудности ЛХЭ при остром холецистите. Артериальное кровотечение
7. Кровотечение из ложа желчного пузыря. Желчеистечение при лапароскопической холецистэктомии
8. Холецистэктомия из мини-доступа. Удаление желчного пузыря из мини-доступа
9. История холецистэктомии. Методы удаления желчного пузыря
10. Преимущества и недостатки различных видок холецистэктомии. Хирургический стресс
Источник
Это осложнение резко
затрудняет операцию и является одной
из основных причин конверсии. Частота
серьёзного кровотечения при ЛХЭ,
требующего лапаротомии, достигает
0,25%. Источником геморрагии могут быть:
1. Пузырная артерия (pис.
10-27.)
2. Правая печёночная артерия
3. Общая печёночная аретрия
(pис.
10-28.)
4. Воротная вена
5. Сосуды ложа жёлчного
пузыря
Рис. 10-27. Кровотечение
из пузырной артерии Это
Фото.
Рис. 10-28. Кровотечение
из общей печёночной артерии Есть
фото
Диагностика интраоперационного
кровотечения очевидна, однако для
выработки адекватной тактики гемостаза
необходимо понимание топографической
анатомии. Если источник кровотечения
точно не идентифицирован, нельзя
использовать коагуляцию или клипирование,
поскольку это ведёт к ещё бЏльшим
осложнениям. Как правило, в случаях
профузного кровотечения и неясной
анатомии показан переход к «открытой»
операции. Лечебная тактика при ранениях
сосудов гепатодуоденальной связки
зависит от локализации и размеров
повреждения. Кровотечение при точечных
ранениях крупных сосудов останавливают
прижатием и местным использованием
гемостатиков. Повреждения воротной
вены и общей печёночной артерии требуют
наложения сосудистого шва. Повреждение
правой печёночной артерии допускает
её лигирование. Кровоснабжение печени
существенно не пострадает.
Кровотечение из ложа жёлчного
пузыря опасно тем, что может быть
неправильно оценено во время операции.
Именно этот вид геморрагии часто требует
выполнения лапаротомии в раннем
послеоперационном периоде. При подозрении
на кровотечение показана релапароскопия.
Умеренная кровопотеря (до 200 мл) допускает
проведение лапароскопического гемостаза.
При бЏльшем кровотечении показана
лапаротомия. Для профилактики этого
осложнения рекомендуют во всех
сомнительных случаях использовать
местнодействующие гемостатические
средства (гемостатическую губку,
фибриновую пленку и др.).
Литература
1.
Гальперин Э.И., Дедерер Ю.М. Нестандартные
ситуации при операциях на печени и
жёлчных путях. М., 1987. С.336.
2.
Милонов О.Б., Тоскин К.Д., Жебровский В.В.
Послеоперационные осложнения и опасности
в абдоминальной хирургии.—
М.: Медицина,
1990.— 560с.
3.
Richardson MC, Bell G, Fullarton GM Incidence and nature of bile duct
injuries following laparoscopic cholecystectomy: an audit od 5913
cases Br.
J. Surg. 1996,
83, 1356-1360.
4.
Davidoff AM, Pappas TN, Murray EA et al: Mechanisms of major biliary
injury during laparoscopic cholecystectomy.
Ann. Surg.
1992; 215/3: 196-202.
5.
Bismuth H. Postoperative strictures of the biliary tract In:
The Biliary Tract, Clinical Surgery International vol
5 L.H.Blumgart, editor, Edinburgh, Churchill-Livingstone, 1983, pp209
— 218
6.
Deziel D.J.,Millikan K.W., Economou S.G., Doolas A., Sung-Tao Ko,
Airan M.C. Complications of laparoscopic cholecystectomy: a national
survey of 4,292 hospitals and an analysis of 77,604 cases. Am
J Surg,.vol
165, january, 1993,pp9 — 14
7.
Пиковский
Д.Л.- Г.Кер, С.П.Фёдоров и хирургия жёлчных
путей: прошлое и настоящее. —
Анналы хирургической гепатологии,
1996, т.1, с. 136 — 143.
8.
Martin R.F.,
Rossi
R.L. Bile duct injuries. Spectrum, mechanisms of injury and their
prevention.
Surg Clin North Am 1994.
74/4: 781-803
9.
Rossi R.L.,
Tsao J.I. Biliary reconstruction. Surg
Clin North Am 1994;
4: 825-841
10.Moossa
A.R.,Easter D.W.,
van
Sonnenberg E., Casola G.,D’Agostino H: Laparoscopic injuries to the
bile duct.
Ann Surg
1992;215/03: 203-208.
11.
Hawasli A; Does routine cystic duct cholangiogram during laparoscopic
cholecystectomy prevent common bile duct injury? Surg
Laparosc Endosc 1993;
3/4: 290-295.
12.
Chia-Long Lee, Chi-Hwa Wu, Tzen-Kwan Chen, Yung-Chin Lai, Sien-Sing
Yang, Ching-Shui Huang, Der-Fang Chen. Prospective study of abdominal
ultrasonography before laparoscopic cholecystectomy; J
Clin Gastroenterol; 1993
16/2 113-116.
13.
Fried G.M., Barkun J.S. Sigman H.H., et al. Factors determining
conversion to laparotomy in patients undergoing laparoscopic
cholecystectomy.
Am J Surg 1994
vol 167; 1; 35-41
14.
Horvath K.D: Strategies for the prevention of laparoscopic common
bile duct injuries.
Surg Endosc
1993; 7; 439-444.
15.
Morgenstern L., Berci G., Pasternak E.H. Bile leakage after biliary
tract surgery.
Surg
Endosc; 1993,7,
432-438.
16.
Halevy A., Gold-Deutch R., Negri M et al.
Are
elevated liver enzymes and bilirubin levels significant after
laparoscopic cholecystectomy in the absence of bile duct injury.
An Surg.
1994, 219/4 362-364.
17.
Morgenstern L., Berci G., Pasternak E.H. Bile leakage after biliary
tract surgery. Surg
Endosc (1993)
7: 432-438.
18.
Brandabur J.J., Kozarek R.A. Endoscopic repair of Bile Leaks After
Laparoscopic Cholecystectomy. Seminars
in Ultrasound, CT, and MRI, N.5,
1993: pp. 375-380.
19.
Dawson S.L., Mueller P.R. Interventional radiology in the management
of bile duct injuries Surg
Clin N Am 1994,
V.74, N.4, pp.865-873.
20.
Rossi R.L., Tsao J.I. Biliary reconstruction. Surg
Clinics North Am.
1994 vol 74. N4 825-841)
21.
Кузовлёв
Н.Ф. Рубцовая стриктура печёночных
протоков (стриктура 0). Прецизионный
жёлчно-кишечный анастомоз без
дренажа-каркаса. Анналы
хирургической гепатологии,
1996, том 1, с. 108-114.
22.
Лапкин
К.В., Малярчук В.И., Базилевич Ф.В., Русанов
В.П. Прецизионная хирургия доброкачественных
заболеваний жёлчевыводящих протоков.
Труды международной конференции «Новые
технологии в диагностике и в хирургии
органов билиопанкреатодуоденальной
зоны». Москва, 1995. С. 106-108.
23.
Лапкин
К.В., Климов А.Е., Тедорадзе Р.В. Принципы
безопасности при выполнении
лапароскопической холецистэктомии.
Труды международной конференции «Новые
технологии в диагностике и в хирургии
органов билиопанкреатодуоденальной
зоны». Москва,
1995. С. 173-174.
24.
Фёдоров
И.В., Славин Л.Е. Повреждения жёлчных
протоков при лапароскопической
холецистэктомии. Казань, 1995, 72с.
25.
Mathisen Q.,Bergan A.,Flatmark A. Iatrogenic bile duct injuries.
World
J Surg
1987, 11, 392-397.
26.
Капранов
С.А., Авалиани М.В., Кузнецова В.Ф.
Чрезпечёночные эндобилиарные вмешательства
при стриктурах жёлчных протоков. Анналы
хирургической гепатологии, 1997,
том 2, с. 123-131.
11
Лапароскопическая
аппендэктомия
Аппендэктомия — одна из
наиболее распространенных операций в
хирургической практике. Острый аппендицит
на протяжении жизни возникает у 7%
населения. К нерешённым проблемам
лечения этого заболевания относят не
только позднюю диагностику с развитием
тяжелых осложнений, но и напрасные
аппендэктомии, частота которых достигает
20 — 40%. Полноценная ревизия брюшной
полости, при обнаружении неизмененного
червеобразного отростка, через разрез
в правой подвздошной области невозможна.
Напрасная аппендэктомия может привести
к нежелательным последствиям как в
ближайшем, так и в отдалённом
послеоперационном периоде. К последним
относят вторичное бесплодие у женщин,
спаечную непроходимость кишечника,
образование грыж и др. Лапароскопия
позволяет установить точный диагноз
острого аппендицита в 95 — 97% случаев, а
при соответствующих показаниях —
выполнить лапароскопическую аппендэктомию
(ЛА) [1-8].
Однако, преимущества
эндохирургии в лечении аппендицита
проявляются не столь ярко, как в хирургии
ЖКБ или в оперативной гинекологии по
следующим причинам:
1. Аппендэктомия в типичных
случаях — малотравматичная операция,
выполняемая через небольшой разрез без
пересечения мышц брюшной стенки.
2. Выполнение лапароскопической
аппендэктомии требует общего обезболивания
3. Для выполнения ЛА необходимо
дорогостоящее оборудование и подготовленный
персонал
4. Специфика неотложной
хирургии предусматривает выполнение
операций в вечернее и ночное время
Показания к ЛА те же,
что и к «открытой» операции. Однако, за
последние годы были выделены группы
пациентов с острым аппендицитом, у
которых ЛА имеет несомненные преимущества:
1. Клиническая ситуация,
когда невозможно исключить острый
аппендицит в результате динамического
наблюдения. Диагностическая лапароскопия
позволяет уточнить диагноз и перейти
к ЛА, которая технически выполнима у
70% пациентов.
2. Женщины репродуктивного
возраста, у которых клинически сложно
провести дифференциальную диагностику
между острым аппендицитом и острой
гинекологической патологией. У этой
категории больных частота напрасных
аппендэктомий достигает 22-47%
(у мужчин — 7-15%), что приводит к нежелательным
последствиям в виде спаечной болезни
и вторичного бесплодия. Особое значение
имеет косметический эффект операции
3. Сопутствующий сахарный
диабет, когда вероятно развитие раневых
осложнений
4. Тучные пациенты, когда
традиционная аппендэктомия требует
широкого кожного разреза и часто
осложняется нагноением раны
5. Желание пациента
Противопоказания
включают в себя:
1. Продолжительность
заболевания более 24 часов
2. Плотный аппендикулярный
инфильтрат, периаппендикулярный абсцесс
3. Тифлит с выраженной
инфильтрацией основания аппендикса
4. Разлитой перитонит
5. Общие противопоказания
к лапароскопии (коагулопатия, поздние
сроки беременности, ХОЗЛ, инфаркт
миокарда, сердечно-сосудистая
недостаточность)
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Печеночная артерия. Пузырная артерия. Треугольник Calot. Лимфатическая система желчного пузыря и желчных протоков.
После отделения гастродуоденальной артерии печеночная артерия следует вертикально вверх, внутри печеночно-двенадцатиперстной связки, впереди и слева от общего желчного протока, который занимает свободный край гепатодуоденальной связки. Портальная вена следует позади печеночной артерии. Проксимальнее к воротам печени печеночная артерия делится на правую и левую печеночные артерии. Правая печеночная артерия проходит позади общего печеночного протока и входпт в треугольник Calot. В некоторых случаях правая печеночная артерия, как будет видно ниже, проходит впереди общего печеночного протока.
Пузырная артерия
В большинстве случаев пузырная артерия начинается от правой печеночной артерии, в пределах треугольника Calot, справа от печеночного протока. Она подходит к пузырному протоку и шейке желчного пузыря, обычно над ним и несколько сзади. Достигнув желчного пузыря, разделяется надае ветви: переднюю, которая идет в подбрюшинном пространстве желчного пузыря, и заднюю, идущую в ложе между желчным пузырем и печенью. Пузырная артерия может иметь многочисленные варианты анатомического строения. Она может возникать из правой печеночной артерии и идти не впереди общего желчного протока, а позади него. Она может также начинаться от левой печеночной артерии и идти перед общим желчным протоком. Пузырная артерия иногда возникает из общей печеночной, гастродуоденальной (желудочно-двенадцатиперстной), левой желудочной, правой желудочной или верхней брыжеечной артерии. В 20% случаев имеются две пузырные артерии — передняя и задняя.
Треугольник Calot
В 1891 г. Jean Francois Calot описал очень важныйдля хирургии желчных путей треугольник. Этот треугольник сформирован справа — пузырным протоком и шейкой желчного пузыря, слева — общим печеночным протоком (печеночно-пузырный угол), а также нижним основанием печени, формирующим треугольник. В этом треугольнике определяют печеночную и пузырную артерии.
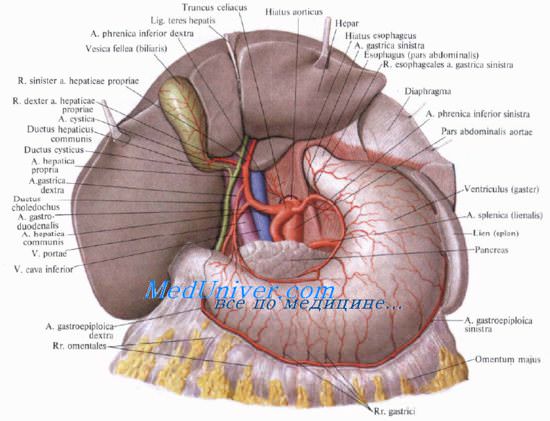
Артериальное кровоснабжение гепатикохоледоха
Артериальное кровоснабжение гепатикохоледоха очень вариабельно. Множественные артерии малого калибра возникают из верхней и задней поджелудочно-двенадцатиперстных артерий, супрадуоденальной, пузырной, общей печеночной артерии и т. д. Травма этих сосудов при повторных операциях способствует образованию стриктур гепатикохоледоха. Восстановить гепатикохоледох при поперечных стриктурах легче, чем при продольных.
Венозный отток от внепеченочных желчных протоков
Венозный возврат от желчного пузыря осуществляется с помощью многочисленных вен малого калибра, которые идут от желчного пузыря к паренхиме печени. Эти вены возникают со всех сторон желчного пузыря, как от его ложа, так и от подбрюшинных областей. В редких случаях можно найти пузырную вену, которая входпт в воротную вену или ее правую ветвь. Венозный отток от гепатикохоледоха осуществляется сплетением, которое покрывает переднюю стенку общего желчного протока. Оно используется для распознавания общего желчного протока. Сплетение может послужить причиной досадного кровотечения во время операции в этой зоне.
Лимфатическая система желчного пузыря и желчных протоков
Лимфатические сосуды желчного пузыря идут к паренхиме печени, к узлам гепатикохоледоха, к верхним поджелудочным и чревным узлам.
Выше и рядом с шейкой желчного пузыря обычно располагаются лимфатические узлы, известные как пузырные, или узлы Mascagni.
Позади нижней части общего желчного протока обычно имеется лимфатический узел, называемый «узлом холедоха», который часто используют для распознавания общего желчного протока.
Учебное видео анатомии желчного пузыря, желчных протоков и треугольника Кало
Скачать данное видео и просмотреть с другого видеохостинга можно на странице: Здесь.
— Также рекомендуем «Холецистэктомия. Удаление желчного пузыря. Показания к холецистэктомии.»
Оглавление темы «Хирургия желчных путей.»:
1. Хирургическая анатомия желчного пузыря и пузырного протока.
2. Хирургическая анатомия общего желчного протока. Фатеров сосочек и его изучение.
3. Анатомия фатерова сосочка. Хирургическая анатомия сфинктера Одди.
4. Печеночная артерия. Пузырная артерия. Треугольник Calot. Лимфатическая система желчного пузыря и желчных протоков.
5. Холецистэктомия. Удаление желчного пузыря. Показания к холецистэктомии.
6. Техника холецистэктомии. Обработка ложа желчного пузыря.
7. Холецистэктомия через мини доступ. Техника холецистэктомии от дна желчного пузыря.
8. Холецистостомия. Показания к холецистостомии. Холецистостомия под местной анестезией.
9. Техника традиционной холецистостомии. Методика обычной холецистостомии.
10. Исследование общего желчного протока. Методы исследования без холедохотомии.
Источник
Интраоперационное кровотечение при лапароскопической холецистэктомии и варианты его остановки
Горский В. А.
Кригер А. Г.
Шуркалин Б.К.
Ованесян Э. Р.
Герцог А. А.
Воскресенский П. К.
Кафедра хирургии (зав. — проф. Б.К. Шуркалин), РГМУ, Москва
Лапароскопическая холецистэктомия была произведена 1657 больным с желчнокаменной болезнью и ее осложнениями. Гемостаз во время операций в основном обеспечивали биполярной коагуляцией, монополярную коагуляцию применяли лишь в начале работы. Интенсивные или упорные интраоперационные кровотечения возникли у 85 (5,1%) больных. Источниками кровотечения являлись ложе желчного пузыря — 66 (3,9%), пузырная артерия или ее культя — 14 (0,8%), печеночная артерия — 2 (0,1%), прочие — 3 (0,1%). Для остановки кровотечения применяли марлевый тампон (МТ) у 7 больных, тампонаду гемостатической губкой (ГГ) у 10, орошение раствором тромбина (РТ) у 16, аппликацию пластины ТахоКомба (ТК) — 31 больной. Конверсия потребовалась 2 больным. Исследование показало, что биполярная коагуляция обеспечивает надежный гемостаз и позволяет избежать электротравм органов. Обеспечение окончательного гемостаза МТ увеличивает травматичность операции, ухудшает течение послеоперационного периода. Применение ГГ и РТ оправдано лишь при неинтенсивном капиллярном кровотечении. При венозном и паренхиматозном кровотечениях из ложа желчного пузыря, которые не удается остановить электрокоагуляцией, точечных повреждениях крупных сосудов гепатодуоденальной связки, перихоледохеальных сосудов оптимальным методом гемоетаза является аппликация ТК. Обеспечение надежного гемоетаза во время лапароскопических операций может представлять сложную задачу. Именно поэтому кровотечение является одной из основных причин конверсии при лапароскопической холецистэктомии — ЛХЭ [2, 3, 6, 8]. Наиболее распространенный способ гемостаза в лапароскопической хирургии — монополярная коагуляция — далеко не всегда может обеспечить надежный гемостаз и чревата опасностью электротравмы. Поэтому разработка методов остановки кровотечений, особенно в технически сложных ситуациях, всегда актуальна. Целью настоящего сообщения является изложение результатов анализа различных методов гемоетаза при ЛХЭ.
Материал и методы
С 1993 по 2000 г. в клинике кафедры хирургии медико-биологического факультета Российского государственного медицинского университета выполнено 1657 ЛХЭ. По поводу желчнокаменной болезни и хронического холецистита оперировано 895 (54%) больных, по поводу различных форм острого холецистита — 752 (46%) пациента. Возраст больных колебался от 17 до 92 лет. Интенсивные или упорные кровотечения во время операций возникли у 85 (5,1%) больных. Источниками кровотечения явились ложе желчного пузыря у 66 (3,9%) больных, пузырная артерия у 14 (0,8%), печеночная артерия у 2 (0,1%), сосуды большого сальника, мелкие перихоледохеальные сосуды, сосуды передней брюшной стенки по 1 наблюдению.
В начале работы (1993-1994 гг.) мы применяли монополярную коагуляцию, в последующем — только биполярную. Пузырную артерию всегда клипировали. При безуспешности электрокоагуляции ложа пузыря У 66 больных в целях окончательной остановки кровотечения использовали марлевый тампон — МТ (7), тампонаду гемостатической губкой — ГГ (10), орошение раствором тромбина — РТ (16), аппликацию пластины ТахоКомба — ТК (31). Конверсия потребовалась 2 больным в период, когда использовалась лишь монополярная коагуляция.
МТ и пластины ГГ вводили через порт 20-миллиметрового троакара или через отдельный мини-разрез в правом подреберье. Орошение РТ осуществляли посредством аквапуратора. ТК накладывали обычными эндоскопическими инструментами (рис. 1) через 10-миллиметровый порт или с помощью лапароскопических аппликаторов «ENDOdock» (рис. 2) и АМISА (рис. 3).
Рис. 1. Аппликация ТК на ложе желчного пузыря при помощи обычных эндоскопических инструментов.
Рис. 2. Аппликация ТК при помощи инструмента «Эндодок».
Рис. 3. Аппликация ТК при помощи инструмента АМISА.
Результаты и обсуждение
Проведенный нами анализ отечественных источников литературы, в которых публикуются обобщенные данные различных хирургических школ, показал, что количество неконтролируемых кровотечений из ложа желчного пузыря во время ЛХЭ колеблется от 0,7 до 4,1% (табл. 1). Количество конверсии при этом осложнении подчеркивает важность проблемы и требует тщательного изучения.
Таблица 1. Сводные данные возникновения неконтролируемых кровотечений из ложа пузыря при ЛХЭ
| Авторы | годы | Число ЛХЭ | Количество кровотечений | Количество конверсий |
| А.Г. Бебуришвили и соавт. | 1995-1998 | 2600 | 96 (3,7) | 18 (0,7) |
| А.Е. Борисов и соавт. | 1997-1999 | 16873 | 117 (0,7) | 102 |
| Ю.И. Галлингер и соавт. | 1991-1999 | 2285 | 4 (0,2) | Нет |
| А.А. Голубев и соавт. | 1994-1999 | 1340 | 55 (4,1) | Нет данных |
| Я.И. Гордовский и соавт. | 1994-1998 | 4081 | 5 (0,12) | 4 (0,1) |
| Ш.И. Каримов и соавт. | 1994-1999 | 1067 | 30 (2,8) | Нет данных |
| М.Е. Ничитайло и соавт. | По 1999 | 4500 | 52 (1,8) | 52 (1,8) |
| В.Г. Сахаутдинов и соавт. | 1994-1999 | 1116 | 13 (1,16) | Нет данных |
| Г.Г. Устинов и соавт. | По 1999 | 1362 | 42 (3,1) | 42 (3,1) |
Примечание: в скобках — показатели в процентах.
Опыт применения монополярной коагуляции свидетельствует, что она обеспечивает надежный гемостаз при выполнении технически простых вмешательств при желчнокаменной болезни и хроническом холецистите. Эффективны как коагуляционный крючок, так и коагуляция зажимом. В этих случаях при диссекции тканей удается работать «в слое», четко визуализировать структуру тканей, идентифицировать атипично расположенные сосуды. При наличии воспалительной инфильтрации тканей эффективность монополярной коагуляции резко уменьшается за счет скопления в тканях значительного количества жидкости. Электрокоагуляционный крючок в данных условиях обеспечивает лишь режущее действие, в то время как гемостатический эффект практически отсутствует. При коагуляции зажимом или диссектором существенно увеличивается опасность недозированной коагуляции тканей. В начале нашей работы при использовании монополярной коагуляции в 2 наблюдениях мы отметили интенсивное кровотечение из ложа пузыря, что потребовало конверсии. В 1 наблюдении произошло повреждение коагуляционным крючком передней брюшной стенки, что вызвало кровотечение, остановившееся лишь после прошивания через все ткани.
Биполярная коагуляция дает более выраженный гемостатический эффект, в том числе при работе в инфильтрированных тканях. При возникновении кровотечения из сосудов диаметром 1-2 мм, при условии захвата их в биполярный зажим, удавалось получить дозированный по площади коагуляционный некроз, что обеспечивало достаточно надежный гемостаз. Однако в тех ситуациях, когда поврежденный сосуд не удавалось четко идентифицировать в ложе пузыря, приходилось интенсивно коагулировать паренхиму печени в области предполагаемого источника кровотечения. Избыточная коагуляция тканей приводила к длительному субфебрилитету в послеоперационном периоде.
Использование для окончательного гемостаза в начале нашей работы МТ у 7 больных оказалось неэффективным. Гемостаз был обеспечен во всех наблюдениях, однако дополнительная травма передней брюшной стенки и наличие самого тампона отягощали течение послеоперационного периода. Раны по месту тампонады заживали вторичным натяжением, а у 2 больных не удалось избежать раневой инфекции. При контрольном осмотре через 1-3 года у 3 больных выявлена послеоперационная грыжа. Таким образом, применение МТ, обеспечивая гемостаз при паренхиматозном кровотечении, сводит на нет преимущества миниинвазивного вмешательства.
Биологические методы местного гемостаза в виде ГГ и РТ, использованные у 26 больных, были эффективными лишь при неинтенсивных паренхиматозных кровотечениях. При использовании ГГ практически у всех больных сохранялась субфебрильная температура на протяжении 3-5 дней послеоперационного периода. У 1 больной сформировался подпеченочный абсцесс, у 1 — воспалительный инфильтрат. При использовании РТ подпеченочный абсцесс возник у 1 больной. Гнойные раны лечили общепринятыми методами, полости абсцессов пунктировали под контролем ультразвука и дренировали. Сформировавшийся в подпеченочном пространстве в ближайшем послеоперационном периоде инфильтрат у больной с ГГ постепенно регрессировал под действием антибактериальной терапии.
ТК был использован у 12 больных с интенсивным венозным кровотечением из ложа пузыря и у 19 больных с упорным паренхиматозным кровотечением. Во всех наблюдениях получен абсолютный гемостаз. В послеоперационном периоде осложнений не отмечалось. Дренажи из брюшной полости были удалены у основной массы больных на следующий день после операции.
Мы провели анализ количества отделяемого по дренажам, сроков нахождения дренажей в брюшной полости и продолжительности пребывания в стационаре после операции больных при использовании различных дополнительных методов гемостаза для определения оптимального метода. Наибольшая продолжительность стояния дренажей (до 5 сут) отмечалась в группах с ГГ и РТ (табл. 2). В этих группах основную массу дренажей удаляли на 3-4-е сутки. У больных с ГТ дренажи убирали на 2-3-и сутки из-за нецелесообразности их длительного нахождения, так как отток раневого содержимого осуществлялся в основном по тампону. У 25 больных с ТК дренажи были удалены в 1-е сутки послеоперационного периода, у 5 — на 2-е сутки и только у 1 больного — на 3-й сутки. Сравнивая среднюю продолжительность стояния дренажа, можно отметить, что этот показатель был больше у больных с ГГ (3,7 дня) и меньше у пациентов, при лечении которых использовали ТК (1,9 дня). Длительность стояния зависела от количества отделяемого по дренажу (табл. 3).
Таблица 2. Сроки удаления дренажей
| Метод гемостаза | Сутки | Средняя продолжительность стояния дренажа, дни | ||||
| 1-е | 2-е | 3-е | 4-е | 5-е | ||
| ГТ | — | 1 | 6 | Удалены | Удалены | 2,9 |
| ГГ | — | — | 4 | 5 | 1 | 3,7 |
| РТ | — | 3 | 9 | 3 | 1 | 3,1 |
| ТК | 25 | 5 | 1 | Удалены | Удалены | 1,9 |
Таблица 3. Среднее количество отделяемого по дренажам (в мл)
| Метод гемостаза | Сутки | ||||
| 1-е | 2-е | 3-е | 4-е | 5-е | |
| ГТ | 60 (n = 7) | 52,9 (n = 7) | 40 (n = 6) | Удалены | Удалены |
| ГГ | 78 (n = 10) | 74 (n = 10) | 57 (n = 10) | 30 (n = 6) | 10 (n = 1) |
| РТ | 89 (n = 16) | 65 (n = 16) | 34 (n = 13) | 37 (n = 4) | 20 (n = 1) |
| ТК | 32 (n = 31) | 32 (n = 6) | 20 (n = 1) | Удалены | Удалены |
Примечание: n — количество больных.
Среднее количество геморрагического экссудата, выделяемого по контрольному дренажу из подпеченочного пространства в 1-е сутки, преобладало в группах с РТ и ГГ — 89,4 и 78 мл соответственно. Несколько меньше выделялось у больных первой группы (60 мл), что вполне объяснимо гемостатическим действием тампона и частичными потерями по нему. Отделяемого по дренажам в последней группе было практически в 2-2,5 раза меньше, чем в предыдущих. Подобная тенденция сохранялась и в последующие сутки.
Наличие тампонов, которые удаляли на 6-7-е сутки, и осложнений в виде нагноения послеоперационной раны у 2 больных привели к увеличению продолжительности пребывания на койке после операции в группе с ГТ до 15,1 дня (от 14 до 21 дня). У больных с ГГ и РТ этот показатель был приблизительно одинаковым — в среднем 9,1 и 8,6 койко-дня соответственно. В группе больных с ТК осложнений не наблюдали, больных выписывали на 4-6-е сутки (в среднем 5,5 койко-дня).
Кровотечение из культи пузырной артерии возникло у 6 больных. Повреждение типично расположенной артерии до ее клипирования произошло у 2 больных с острым окклюзионным деструктивным холециститом, кровотечение из дополнительной артерии желчного пузыря было у 4 больных, прорезывание клипсы на культе артерии привело к кровотечению у 2 больных. Во всех наблюдениях остановка кровотечения была сопряжена с трудностями. Скопление крови в брюшной полости значительно ухудшает видимость за счет светопоглощения. Поврежденный сосуд, как правило, сокращался и «тонул» в жировой клетчатке гепатодуоденальной связки. При остановке кровотечения из пузырной артерии использовали только клипирование. Электрокоагуляцию считали недопустимой из-за близости элементов гепатодуоденальной связки. Для надежного наложения клипсы культю пузырной артерии захватывали зажимом и клипсу накладывали ниже зажима, убедившись, что клипса не пережала стенку желчных протоков, печеночную артерию.
Кровотечение из печеночной артерии было у 2 больных: у одного вследствие точечного повреждения иглой при ушивании холедохотомического отверстия, у другого в результате пристеночного отрыва дополнительной пузырной артерии. В таких ситуациях недопустимо использование ни электрокоагуляции, ни клипирования. В обоих наблюдениях кровотечение было остановлено аппликацией ТК.
У 1 больной возникло интенсивное кровотечение из перихоледохеальных сосудов при холедохотомии. После ушивания холедохотомического отверстия кровотечение продолжалось. При этом применение электрокоагуляции и клипирования было невозможно. Гемостаз обеспечен также аппликацией ТК.
Источник