Целлюлоза в остановке кровотечений
Оглавление темы «Шовный материал. Оперативная техника.»: Техника окончательной остановки кровотечения из сосудов подкожной жировой клетчатки. Окончательная остановка кровотечения из сосудов подкожки.Шовный материал (кетгут № 000 — 1, шелк или синтетические рассасывающиеся нити длиной 20—25 см), ножницы Купера. Для перевязки сосуда, фиксированного зажимом, ассистент так приподнимает и поворачивает зажим, чтобы стал виден конец его губок («носик»). Хирург обводит лигатуру вокруг зажима так, чтобы завязать узел на сосуде, под «носиком». Для этого сначала делают первый узел на удалении от сосуда, а затем образовавшуюся петлю двумя указательными пальцами спускают до губок зажима, подводя ее под «носик» (рис. 2.20). При неправильном подведении лигатуры под зажим в узел могут попасть губки зажима, и сосуд не будет перевязан.
Затем выполняют основной прием, требующий слаженной, синхронной работы хирурга и ассистента. Хирург начинает затягивать узел под «носиком», а ассистент плавно раскрывает замок зажима и разводит его бранши. В этот момент хирург окончательно затягивает узел, что должно совпасть по времени с удалением зажима с сосуда. Если зажим будет снят раньше, чем затянут первый узел, то лигатура соскользнет с сосуда. Не ослабляя натяжения концов нитей, завязывают второй, фиксирующий узел (рис. 2.21).
При использовании синтетических нитей завязывают и третий узел. Концы лигатур сразу же срезают ножницами очень коротко, оставляя 0,2—0,3 см (на ширину кончика лезвия ножниц). В результате правильно проведенной манипуляции лигатура прочно фиксирована на сосуде и окружающих его тканях, кровотечение остановлено. Видео урок техники перевязки сосуда в ранеДругие видео уроки по топочке находятся: Здесь — Также рекомендуем «Техника рассечения собственной фасции и апоневроза. Разрезание апоневроза и собственной фасции.» |
Источник
Шунтирование коронарных артерий для лечения стенокардии, замена или восстановление клапана сердца, удаление тромбов из легочной артерии – большинство таких сложных кардиохирургических операций выполняются путем стернотомии – продольного рассечения грудины, что обеспечивает открытый доступ к сердцу и магистральным сосудам. Костный мозг грудины хорошо снабжается кровью и поэтому в открытом состоянии сильно кровоточит: за три часа кровопотеря может достигать 500 мл. Для предотвращения кровотечения кардиохирурги во всем мире используют синтетический воск, который втирается в пористую структуру кости. К сожалению, при всей своей эффективности в качестве гемостатического средства, воск имеет ряд серьезных недостатков, которые приводят, в конечном итоге, к ряду осложнений – медленному протеканию процессов регенерации грудины, развитию воспаления. Из 50 тысяч прооперированных пациентов, тысяча человек страдает от подобных осложнений, при этом воспаление грудины не только увеличивает срок госпитализации и стоимость лечения, но и повышает риск летальности.
Хирурги из Новосибирского научно-исследовательского института патологии кровообращения им. акад. Е.Н. Мешалкина совместно с учеными из Новосибирского института органической химии им. Н.Н. Ворожцова СО РАН разработали новый комплексный препарат, который объединяет в себе свойства эффективного гемостатика и антибиотика, предотвращающего развитие инфекционных осложнений, и при этом способствует регенерации тканей.
О том, какие проблемы в кардиохирургии решит новый полифункциональный препарат, корреспонденту журнала «НАУКА из первых рук» рассказали руководитель Центра хирургии аорты, коронарных и периферических артерий ННИИПК д.м.н., профессор Александр Михайлович Чернявский и аспирант Центра, врач сердечно-сосудистый хирург Александра Романовна Таркова. О том, как был создан препарат, рассказали заведующий лабораторией азотистых соединений, д.х.н., профессор Игорь Алексеевич Григорьев и заведующий лабораторией экологических исследований и хроматографического анализа НИОХ СО РАН к.х.н. Сергей Владимирович Морозов.
«В большой кардиохирургии, к сожалению, нельзя вылечить все болезни с помощью стентов, устройств, имплантируемых через периферические сосуды, – приходится делать большие операции, при которых доступ к сердцу мы получаем через открытую грудину, выполняя стернотомию, – говорит д.м.н., профессор А.М. Чернявский, – и здесь мы сталкиваемся с проблемой диффузных кровотечений. Кровотечение грудины значительно ухудшает течение послеоперационного периода у кардиохирургических пациентов.
Много лет назад хирурги заметили, что, так как костный мозг имеет пористую структуру и кровоточит как губка, для остановки и уменьшения кровотечения его можно чем-то затирать. Сначала для этого использовали натуральный пчелиный воск из сот – я очень хорошо помню это время на заре кардиохирургии, когда еще не было стерильного и упакованного заводского воска. Потом появился синтетический воск – его сейчас производят некоторые крупные зарубежные компании, отечественного пока нет. Благодаря воску кровотечение в губчатых тканях становится меньше или вовсе останавливается.
Основной минус воска в том, что он является препятствием для сращения грудины. Сосуды должны прорастать из одной половинки кости в другую, потом должна образоваться фиброзная ткань. Следующий этап – появление костных клеток, потом костной мозоли, то есть это – многоэтапный процесс. Но из-за того, что мы втираем воск, сосуды не могут расти так, как нужно. Более того, воск не растворяется, он очень медленно оплавляется и выталкивается тканями, что замедляет процесс регенерации, способствует плохому заживлению раны, развитию ложных суставов грудины – появляется патологическая подвижность, что приводит к развитию воспаления, в том числе к медиастинитам и остеомиелитам грудины.
По данным мировой литературы послеоперационная стернальная инфекция и нестабильность грудины являются ведущими причинами увеличения заболеваемости, летальности, социально-экономических издержек и дискомфорта пациентов после кардиохирургических вмешательств с выполнением срединной стернотомии. При этом стернальная инфекция встречается в 0,5—2% случаев и увеличивает послеоперационную летальность в несколько раз.
Кто лечил больных, у которых не срастается грудина, знает, насколько это тяжелый труд для врача – многоэтапные операции длятся месяцами, чтобы убрать ложный сустав грудины, убрать воспаление. И как это тяжело для пациентов – у части из них дефект грудины остается на всю жизнь, некоторым приходится протезировать грудину специальными металлическими конструкциями. Это очень дорогостоящее лечение. А происходит все это всего-навсего потому, что мы не можем эффективно и безопасно для больного остановить кровотечение при стернотомии».
Для остановки кровотечения в кардиохирургии помимо синтетического воска возможно использование и других гемостатических средств, наиболее известное в настоящее время – гемостатическая марля «Surgicel» на основе окисленной целлюлозы. К ее недостаткам, помимо высокой стоимости, относятся необходимость после остановки кровотечения удалять «Surgicel» из раны, невозможность использования ее в сосудистой хирургии, в нейрохирургии, и она не предупреждает инфекционные осложнения. Другим эффективным и быстрым способом остановки кровотечения является метод диатермоэлектрокоагуляции – но даже при небольшом прижигании происходит повреждение тканей. Поэтому большинство мировых кардиохирургических центров для остановки кровотечения используют воск. С одной стороны, это обусловлено эффективностью и дешевизной, с другой – отсутствием доступной альтернативы.
«Сегодня все кардиохирурги работают с воском, но мы хотим уйти от этого, – добавляет профессор А.М. Чернявский, – Поэтому возникла идея создать гемостатический препарат, который бы так же хорошо, как имеющиеся средства, останавливал кровотечение, но в ближайшие несколько дней после операции растворялся, не препятствуя прорастанию сосудов и регенерации костных тканей, и при этом снижал бы риск развития стернальной инфекции – то есть, действовал бы комплексно».
С идеей создать новое гемостатическое ванкомицин-содержащее средство кардиохирурги ННИИПК в 2012 г. обратились к коллегам из НИОХ СО РАН.
«Для нас вся эта история началась с заседания Ученого совета ННИИПК, -рассказывает профессор И.А. Григорьев, – на которое я был приглашен с докладом о некоторых наших разработках, представляющих интерес для совместных исследований с целью создания новых продуктов для кардиохирургии. В это время нас интересовала возможность использования целлюлозы в медицине, и при разговоре с профессором А.М. Чернявским была сформулирована задача создания отечественного гемостатика на основе окисленной целлюлозы, которую, как мы потом увидели, можно использовать как средство иммобилизации лекарственных веществ и получать комплексный эффект. Оказалось, что Александр Михайлович Чернявский тоже думает о таких вещах; как раз в то время на Западе стала очень популярной идея “садить” антибиотики на полимеры. Таким образом, интересы наши сошлись».
Выбор антибиотика для профилактики послеоперационных инфекций в составе комплексного препарата был обусловлен тем, какие штаммы в основном вызывают осложнения – в 90% случаев это эпидермальный или золотистый стафилококк, в том числе антибиотико-резистентные штаммы. Самый эффективный препарат в этом случае – ванкомицин, антибиотик первой линии в борьбе с инфекционными осложнениями в сердечно-сосудистой хирургии.
В качестве гемостатика была выбрана окисленная целлюлоза; область применения этого вещества обширна: от медицины до электроники. В медицине она используется и как хороший гемостатик, так как содержит много карбоксильных групп, кислотные свойства которых способствуют эффективному свертыванию крови, и, например, для создания искусственных сосудов или клапанов. Но окисленная целлюлоза используется и как средство иммобилизации других лекарств, в данном случае антибиотика.
«Окисленная целлюлоза хороша тем, что она биосовместима, организм человека ее не отторгает, более того, она обладает эффектом биодеградации – растворяется в организме, – уточняет к.х.н. С. В. Морозов, – в случае решения кардиохирургических задач, это хорошо тем, что, останавливая кровотечение, окисленная целлюлоза не тормозит процесс заживления, а просто выводится из организма.
Еще одна задача выбор препаративной формы лекарства. Кардиохирургам должно быть удобно готовить и наносить препарат на грудину: самый лучший способ – это втирание, поэтому была взята целлюлоза в порошке. Мы научились окислять целлюлозу в виде марли и порошка, достигая гемостатического эффекта не хуже, чем у зарубежных аналогов. Но нас, как химиков, больше интересовал следующий этап – создание «умного» полифункционального лекарства».
К целлюлозе в порошке, окисленной по определенной методике, добавляется ванкомицин в определенной дозе. При добавлении необходимого количества физиологического раствора два вещества за несколько секунд превращаются в пластичную массу, которая отлично наносится на пористую ткань грудины.
«Созданный нами препарат полифункционален, – объяснил С.В. Морозов, – сначала он действует как гемостатик, потом в нужное время начинает выделять антибиотик и работать щитом от инфекции. Уже сами по себе это – инновационные вещи. Но в процессе исследования этого материала выяснилось, что основа полимера обладает еще и свойствами, используемыми в тканевой инженерии, в так называемых скаффолд-технологиях. Окисленная целлюлоза оказывает стимулирующее влияние на пролиферативную функцию соединительной ткани, ее «каркас» представляет собой трехмерный носитель, в котором происходит культивирование клеток, а значит, процесс заживления грудины идет еще быстрее. Более того, наличие полостей в каркасе позволит в будущем развивать это направление, помещать в них какие-то другие лекарственные вещества. Над созданием данного препарата работала целая команда специалистов химиков-органиков: Е.И. Черняк, Н.И. Ткачева, В.И. Родионов, Е.В. Карпова».
«Будущее за полифункциональными препаратами, они позволят снизить нагрузку на организм человека – не нужно будет вводить несколько лекарств, можно ввести одно, но комплексное. Окисленная целлюлоза является гемостатиком и средством доставки лекарственных веществ, на ее основе можно конструировать такие комплексные препараты. Единственная проблема – это то, что в настоящее время в России окисленную целлюлозу нигде в промышленных масштабах не производят, а раньше производство было в Белоруссии и на Украине. В Институте цитологии и генетики СО РАН занимаются выращиванием мискантуса китайского, растения с более высоким содержанием целлюлозы по сравнению с древесиной, получением целлюлозы и изучением возможностей ее дальнейшей модификации. Возможно, в силу того, что интерес к этому природному полимеру есть, производство окисленной целлюлозы все же будет налажено», – добавил И.А. Григорьев.
О результатах исследований нового препарата рассказывает А.Р. Таркова. «На данном этапе, после экспериментов на лабораторных животных, выведенных для медико-биологических лабораторных исследований учеными ИЦиГ СО РАН, мы уже можем говорить об эффективности нового гемостатического ванкомицин-содержащего средства на основе окисленной целлюлозы. Гемостатические свойства (снижение интенсивности кровопотери и уменьшение времени остановки кровотечения) данного препарата не уступают свойствам используемых отечественных и импортных средств. Но, в отличие от воска, препарат полностью рассасывается в организме в среднем через 7–14 дней (воск может быть обнаружен в теле пациента даже через десять лет после операции), а наличие в составе антибиотика, который начинает выделяться в период сращения грудины, предотвращает развитие инфекции и не дает развиваться воспалению».
Гемостатический ванкомицин-содержащий препарат будет использоваться не только в кардиохирургии. В будущем, как отметила А.Р. Таркова, препарат планируется использовать и в общей хирургии – для остановки кровотечений из любых паренхиматозных органов. По словам С.В. Морозова, в таком сочетании препарат может эффективно применяться в нейрохирургии, при лечении военных ранений и ранений при ДТП. Но пока у исследователей есть конкретная цель: решить кардиохирургическую задачу остановки кровотечений и снижения риска развития стернальных инфекций.
«Если мы не допустим осложнений у 80% из тысячи больных, а мы надеемся, что эта цифра будет близка к 100%, это будет очень хорошо. Мы уже доказали эффективность и перспективность препарата, дальше нужно полностью пройти все доклинические испытания, потом провести клинические испытания на безопасность, а затем – клинические на эффективность. Конечно, это не будет быстро – но, думаю, что через три года, максимум пять лет, мы получим препарат, который поможет решить важную проблему в нашей профессии» – пообещал профессор А.М. Чернявский.
Источник
Гемостатические средства — лекарственные средства, способствующие остановке кровотечений. Все гемостатики, в зависимости от механизма действия, подразделяются на три большие группы:
- ингибиторы фибринолиза (антифибринолитики);
- средства, усиливающие свертывание крови (коагулянты);
- средства, понижающие сосудистую проницаемость.
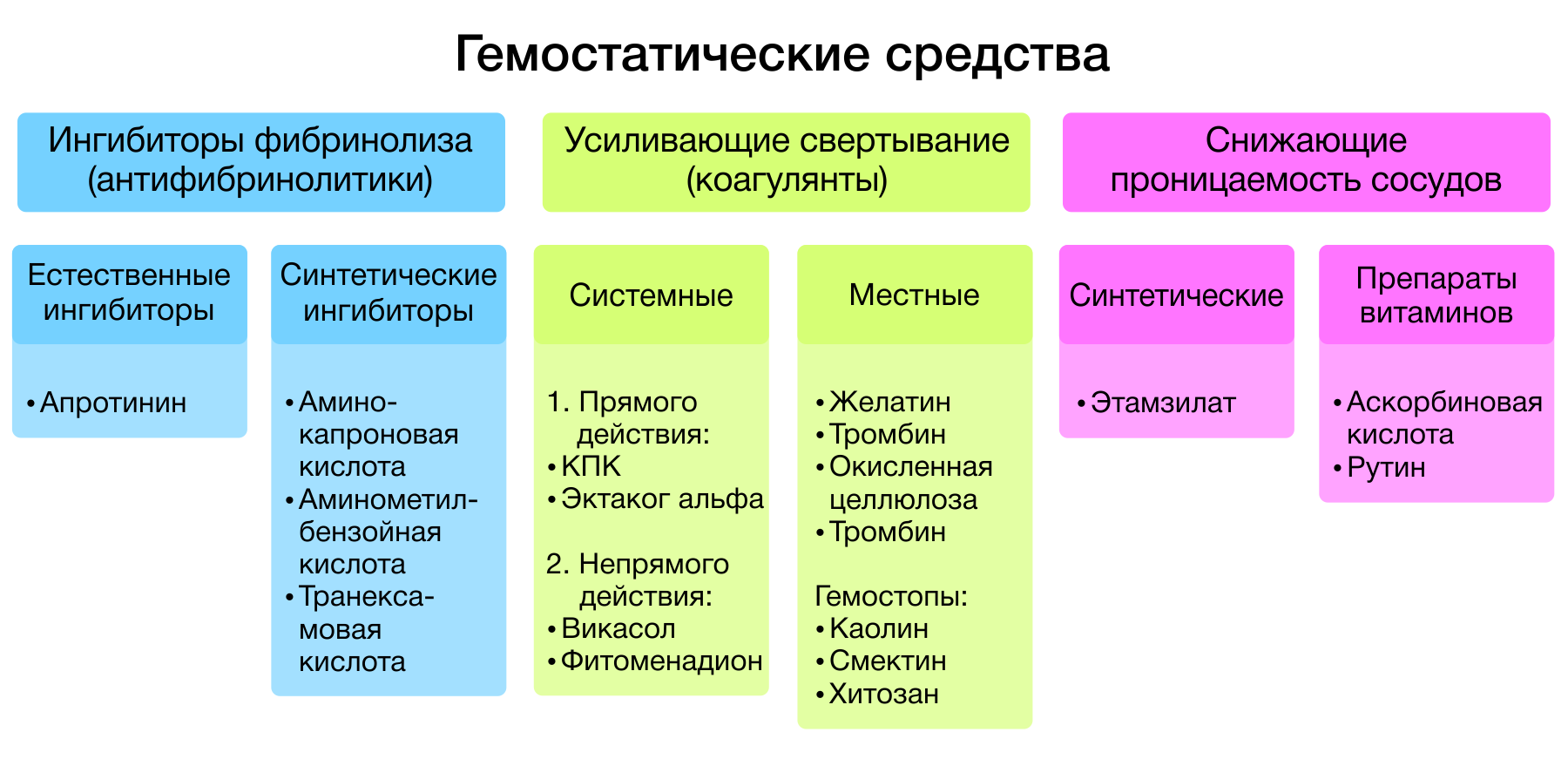
Рисунок 1 | Классификация гемостатиков.
1. Ингибиторы фибринолиза.
В клинической практике широкое распространение получили две группы препаратов ингибиторов фибринолиза: естественные ингибиторы фибринолиза (апротинин и его аналоги) и синтетические ингибиторы фибринолиза (аминокапроновая кислота, аминометилбензойная кислота, транексамовая кислота).
Апротинин — полипептид, получаемый из легких, поджелудочной и околоушной желез крупного рогатого скота, действующий аналогично α2-антиплазмину. Апротинин разрушает свободный плазмин, практически не взаимодействует со связанным плазмином, а также угнетает активацию тромбоцитов. Являясь сериновой протеазой, апротинин блокирует калликреин-кининовую систему путем разрушения калликреина, снижает активность отдельных протеолитических ферментов, таких как: трипсин, химотрипсин, кининогеназа. Изначально препарат был включен в рекомендации по лечению острого панкреатита и панкреонекроза, однако не подтвердил свою эффективность, и показания к его применению были пересмотрены.[1]
Аминокапроновая кислота – 6-аминогексановая кислота — синтетическое производное лизина. Присоединяясь к лизин-связывающему участку плазминогена, аминокапроновая кислота обратимо блокирует процесс фибринолиза, снижает активность стрептокиназы, урокиназы, тканевых киназ, калликреина, трипсина и гиалуронидазы. Аналогичным фармакологическим эффектом обладает производное аминокапроновой кислоты — аминометилбензойная кислота, отличающаяся улучшенной фармакокинетикой. Аминокапроновая кислота снижает активность тромболитических препаратов и может быть использована для нейтрализации их эффекта.
Транексамовая кислота — транс-4-(аминометил)-циклогексанкарбоновая кислота — обратимо блокирует эффект плазминогена, адгезию лейкоцитов и тромбоцитов на поверхность тромба за счет конкурентного ингибирования активатора плазминогена. Оказывает противоаллергическое и противовоспалительное действие посредством подавления образования кининов и других активных пептидов, участвующих в аллергических и воспалительных реакциях. По мощности антифибринолитического действия транексамовая кислота значительно превосходит аминокапроновую кислоту. Активность препарата в плазме сохраняется на протяжении 7-8 часов, в тканях — до 17 часов.[2]
У больных с высоким риском массивной кровопотери в плановой хирургии (сердечно-сосудистая хирургия, травматология и ортопедия, трансплантология) применение ингибиторов фибринолиза уменьшает интраоперационную кровопотерю и снижает потребность в трансфузии донорской крови. На протяжении 20 лет проводилось множество исследований, результаты которых были неоднозначны: мнения склонялись то в пользу апротинина, то в пользу синтетических производных лизина.
В 2007 году компания Bayer завершила исследование BART (Blood conservation using antifibrinolytics in a randomized trial), в котором было изучено действие апротинина у кардиохирургических больных высокого риска. Исследователи выявили большой риск летальных исходов и осложнений при использовании апротинина. В группе апротинина количество больных с массивной кровопотерей было несколько меньше, но 30-дневная летальность на 50% превышала аналогичный показатель в других группах.[3]
После публикации результатов BART компания Bayer уведомила Управление по контролю за качеством пищевых продуктов и лекарственных средств США (FDA) о намерении изъять апротинин с рынка. Показания к назначению были пересмотрены, и препарат был исключен из списка безопасных лекарственных средств.
Огромный мета-анализ позволил сделать вывод, что транексамовая кислота обеспечивает такое же снижение периоперационной трансфузии, какое наблюдается при использовании апротинина, но более безопасна. Согласно рекомендациям Европейского общества анестезиологов по ведению пациентов с массивной периоперационной кровопотерей (2013 г.), при массивном кровотечении рекомендуется применение транексамовой кислоты (20-25 мг/кг); она может быть введена повторно или применяться в виде пролонгированной инфузии (1-2 мг/кг/ч).[4]
2. Препараты, усиливающие свертывание крови
Среди средств, повышающих скорость свертывания крови, выделяют: средства системного действия и для местного применения. К препаратам системного действия относят непрямые коагулянты (фитоменадион, менадиона натрия бисульфит) и коагулянты прямого действия (факторы свертывания: концентрат протромбинового комплекса, эптаког альфа).
Менадиона натрия бисульфит — синтетический водорастворимый аналог витамина К3. Субстратно стимулирует витамин K-редуктазу, активирующую витамин К и обеспечивающую его участие в печеночном синтезе витамин K-зависимых плазменных факторов гемостаза (II, VII, IX, X). Фитоменадион является синтетическим структурным аналогом витамина К1, обладает большей активностью и более ранним началом реализации эффектов (через 6-10 часов после перорального применения, против 18-24 часов у менадиона натрия бисульфита). Данная группа препаратов показана для коррекции нарушений системы гемостаза, вызванных дефицитом витамина К1, передозировкой антикоагулянтов непрямого действия (варфарина), а также для предоперационной профилактики кровотечений.
Концентрат протромбинового комплекса (КПК) — лекарственный препарат, содержащий факторы II, VII, IX, X, а также следовые концентрации антитромбина III, гепарина, протеинов С и S. Основным показанием к применению КПК служит коррекция приобретенного дефицита витамин К1-зависимых факторов в экстренных ситуациях (кровотечение, экстренная операция). Помимо этого, КПК широко используется как средство для лечения и профилактики кровотечений у пациентов с врожденным дефицитом одного из К1 зависимых факторов свертывания (врожденная гипопротромбинемия, врожденный дефицит фактора Стюарта – Прауэра).[5]
Эптаког альфа — рекомбинантный активированный VII фактор свертывания. Механизм действия препарата заключается в прямой активации фактора Х на поверхности активированных тромбоцитов. Это вызывает «тромбиновый взрыв» независимо от имеющейся концентрации факторов VIIIa и IXa. В результате образуется стабильный фибриновый сгусток. Считается, что эптаког альфа инициирует гемостаз только в месте повреждения ткани и не вызывает системной активации механизмов свертывания. Препарат был разработан для лечения кровотечений и проведения хирургических вмешательств у пациентов с наследственной или приобретенной гемофилией и высоким титром ингибитора факторов свертывания VIIIa или IXa. Его применение у пациентов с массивным кровотечением можно сформулировать согласно рекомендациям ESA (2013): «Применение рекомбинантного фактора VII возможно только при кровотечениях, которые не могут быть устранены хирургическими методами или путем комплексной гемостаз-корригирующей терапии». Необходимо серьезное обоснование для применения данного препарата [6].
3. Местные гемостатики
Местные гемостатики используются для остановки капиллярных и паренхиматозных кровотечений преимущественно в неотложной хирургии и стоматологии. Данная группа включает в себя широкий спектр препаратов с различным механизмом действия.
Препараты на основе желатина, получаемого из свиной кожи, существуют в трех формах: пленка, губка и порошок. Желатин чрезвычайно гигроскопичен, и за счет этого свойства он абсорбирует влагу, увеличиваясь в размерах и заполняя тканевой дефект. Существуют комбинации желатина с тромбином, которые помимо пассивного гемостатического эффекта напрямую запускают коагуляционный каскад и активируют тромбоциты в месте нанесения. Желатин разрушается протеиназами в течение 4-6 недель. Несмотря на абсолютную индифферентность, желатин может служить в качестве хронического очага инфекции. Помимо этого, одним из существенных недостатков данных препаратов является отсутствие прочных связей с окружающими тканями [7].
Тромбин является естественным компонентом свертывающей системы крови. Раствор тромбина используют только местно при капиллярных или паренхиматозных кровотечениях в ходе нейрохирургических вмешательств, операций на печени и почках, в стоматологической практике. Попадание тромбина в крупные кровеносные сосуды может вызвать распространенный тромбоз [7].
Окисленная целлюлоза выпускается в виде пленок, сеток, пучков и губок. Данный биологический агент играет роль субстрата для агрегации тромбоцитов и активации механизмов гемостаза. Целлюлоза значительно снижает рН среды, что приводит к лизису эритроцитов с образованием кислого гематина, который формирует дополнительный искусственный сгусток. Помимо этого окисленная целлюлоза обладает антибактериальным эффектом, в том числе в отношении антибиотикорезистентных микроорганизмов [7].
Микрофибриллярный коллаген, производимый из кожи крупного рогатого скота, имеет ряд преимуществ перед остальными топическими биологическими кровоостанавливающими агентами, среди которых: быстрый гемостатический эффект, минимальная реактивность тканей и высокая способность к реабсорбции. Аналогично целлюлозе, микрофибриллярный коллаген является матрицей для активации тромбоцитов, агрегации и образования тромбов [7].
Подвидом местных кровоостанавливающих средств являются гемостопы, получившие большое распространение в военной медицине. Это препараты внешнего воздействия, которые почти не влияют на свертывающую и противосвертывающую системы крови. Многообразие форм выпуска обеспечивает удобство применения в полевых условиях и полностью удовлетворяет потребностям оказания неотложной помощи при любых кровотечениях. На сегодняшний день наиболее эффективным средством считается хитозан.
Хитозан – это полисахаридный биополимер, получаемый из хитиновых панцирей ракообразных. Кровоостанавливающий эффект данного вещества достигается путем связывания хлопьев хитозана с отрицательно-заряженными эритроцитами и образования гелеобразного сгустка в месте контакта с кровью. Среди преимуществ препаратов на основе хитозана выделяют его антимикробные свойства, длительный срок хранения, стабильность при перепадах температур и безопасность при наружном использовании [8].
Наиболее известным представителем группы средств, понижающих сосудистую проницаемость, является этамзилат. Гемостатический эффект данного препарата обусловлен активацией тромбопластина в месте повреждения сосудов микроциркуляторного русла и снижением синтеза простациклина PGI-2 в эндотелии сосудов, что в конечном итоге приводит к усилению адгезии и агрегации тромбоцитов, остановке или уменьшению кровоточивости. За счет антигиалуронидазного действия этамзилат обладает ангиопротективным эффектом, улучшает микроциркуляцию и нормализует проницаемость сосудистой стенки при патологических процессах [9].
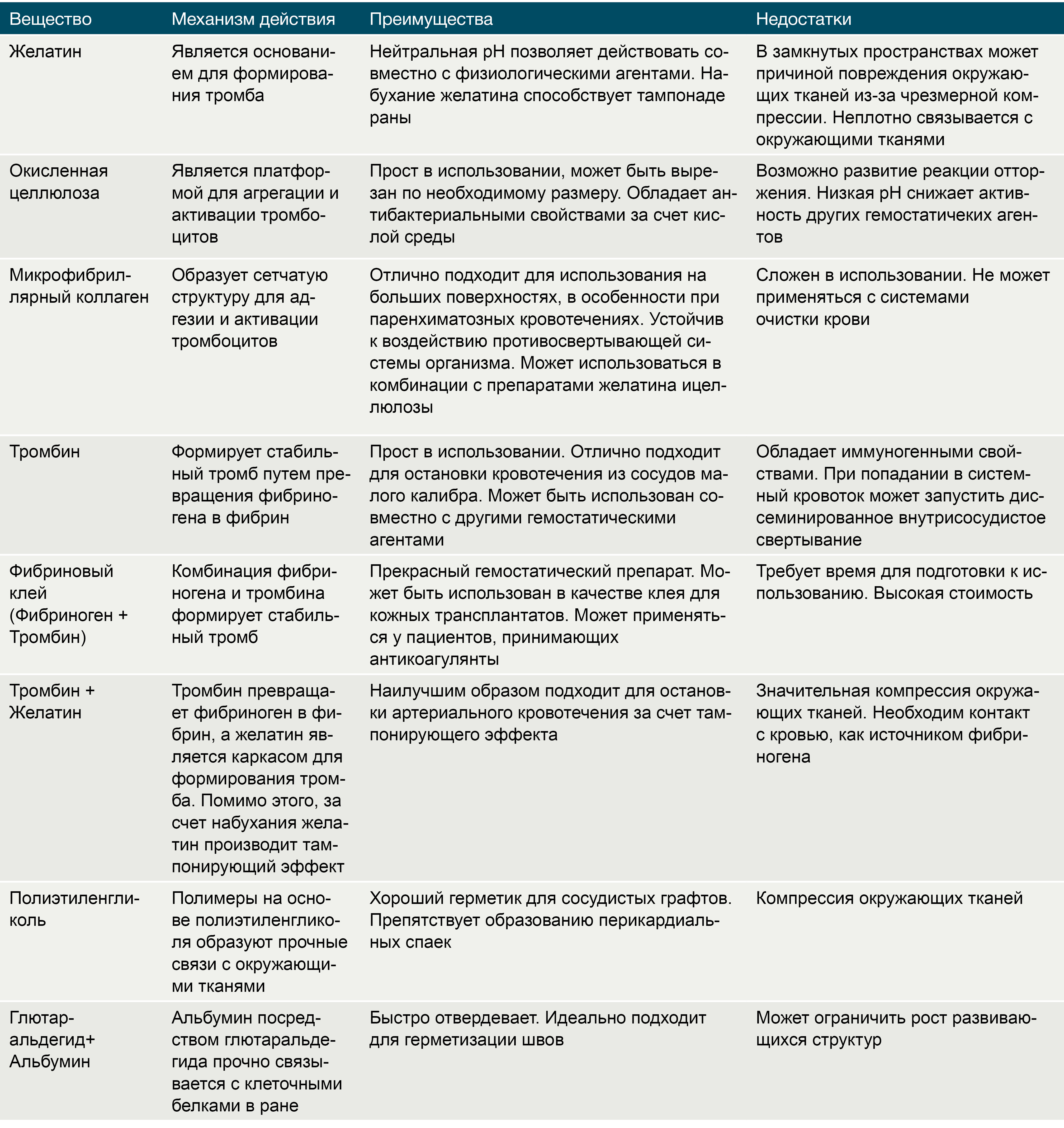 Таблица 1 | Характеристика местных гемостатиков.
Таблица 1 | Характеристика местных гемостатиков.
Источники
- Fergusson D. A. et al. A comparison of aprotinin and lysine analogues in high-risk cardiac surgery //New England Journal of Medicine. – 2008. – Т. 358. – №. 22. – С. 2319-2331.
- Williams-Johnson J. A. et al. Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo-controlled trial //West Indian Medical Journal. – 2010. – Т. 59. – №. 6. – С. 612-624.
- Ferraris V. A. et al. Perioperative blood transfusion and blood conservation in cardiac surgery: the Society of Thoracic Surgeons and The Society of Cardiovascular Anesthesiologists clinical practice guideline //The Annals of thoracic surgery. – 2007. – Т. 83. – №. 5. – С. S27-S86.
- Sedrakyan A., Treasure T., Elefteriades J. A. Effect of aprotinin on clinical outcomes in coronary artery bypass graft surgery: a systematic review and meta-analysis of randomized clinical trials //The Journal of thoracic and cardiovascular surgery. – 2004. – Т. 128. – №. 3. – С. 442-448.
- Song H. K. et al. Safety and efficacy of prothrombin complex concentrates for the treatment of coagulopathy after cardiac surgery //The Journal of thoracic and cardiovascular surgery. – 2014. – Т. 147. – №. 3. – С. 1036-1040.
- Shapiro A. D. et al. Prospective, randomised trial of two doses of rFVIIa (NovoSeven) in haemophilia patients with inhibitors undergoing surgery //Thrombosis and haemostasis. – 1998. – Т. 79. – №. 05. – С. 773-778.
- Achneck H. E. et al. A comprehensive review of topical hemostatic agents: efficacy and recommendations for use //Annals of surgery. – 2010. – Т. 251. – №. 2. – С. 217-228.
- McManus J. G., Wedmore I. Modern Hemostatic Agents for Hemorrhage Control â A Review and Discussion of Use in Current Combat Operations. – 2005.
- Okuma M. et al. Effects of etamsylate on platelet functions and arachidonic acid metabolism //Thrombosis and haemostasis. – 1982. – Т. 48. – №. 3. – С. 330-333.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник